ВИЧ и диабет
-
@васьвась
Имбирь хорош , но есть противопоказания к употреблению жкт, б/п,ссз
Как быть?
Если для + основное это снижение глюкозы от воздействия арвт или в общем ,эффект от имбиря -
Теперь для диабетиков: в интернете снова нашли опасные БАДы.
В свободной продаже в сети обнаружили рецептурные препараты для лечения сахарного диабета II типа, которые продавались под видом биодобавки китайского производства. В ее составе - глибенкламид, предназначенный для нормализации уровня сахара в крови.
Опасный фальсификат либо не работает вовсе, либо приводит к слишком резкому падению сахара. Принимавшие такие БАДы жаловались на боли в поджелудочной железе, учащенное сердцебиение, тремор и другие «побочки».
В Союзе профессиональных фармацевтических организаций информацию подтвердили и сообщили, что количество подделок в интернете и на маркетплейсах растет, даже несмотря то что с 1 октября продавцы БАДов должны маркировать продукцию по системе «Честный знак».
В Росздравнадзоре о проблеме знают.
«На территории России сейчас заблокировано порядка 70 тыс. сайтов и интернет-страниц, незаконно торгующих фармпрепаратами», – отчитались в ведомстве.
В Ozon и Wildberries заявили, что регулярно мониторят свой ассортимент и недобросовестных продавцов, а БАДы появляются на онлайн-витрине только после того, как продавец приложит документы, подлинность которых подтверждается сверкой с Реестром свидетельств о государственной регистрации БАД.
Исполнительный директор Союза профессиональных фармацевтических организаций Лилия Титова отметила, что ассоциация неоднократно выступала за ужесточение ответственности маркетплейсов и ждет внесения соответствующих изменений в законодательство. За БАДы также плотно взялось Роскачество. В общем, обложили со всех сторон.
А пока специалисты призывают перестать покупать сомнительные добавки и использовать только лекарства, назначенные врачом. Самодеятельность чревата опасными осложнениями, вплоть до летального исхода.
-
Есть прямая связь высокого уровня Глюкозы в крови и нарушении работы функций почек , болезни
@Ilya-Antipin , прокомментируете , не медикаментозное но эффективное средство
Объём , чистоту приёма , тиамин в целом !?
⬇️
Бенфотиамин очень Хорошо справляется с уменьшением уровня глюкозы в крови !
Перед примирением проконсультироваться с врачем !
Бенфотиамин выглядит наиболее выгоднее по сравнению с тиамином , тк помимо восполнения B1 ещё и регулирует глюкозу в крови , хорошо справляется и имеет жирорастворимую формулу для лучшего всасыванияОпределить уровнь B1 -Транскетолазы *скрининг
Вытекает * , с крови мы убираем глюкозу но она осаживаеться виде жира на органах - порочный круг какой-то
-
Илья Игоревич, добрый день. Назначили сдать сахар с нагрузкой, терапию пью в 10:00 (дол, лам, Тен), стоит отложить прием препаратов на попозже?
-
Пользователь @elenaelena написал в ВИЧ и диабет:
Илья Игоревич, добрый день. Назначили сдать сахар с нагрузкой, терапию пью в 10:00 (дол, лам, Тен), стоит отложить прием препаратов на попозже?
Можете спокойно пропустить 1 день приема
-
Патогенез
Есть материалы оценки с исходными значениями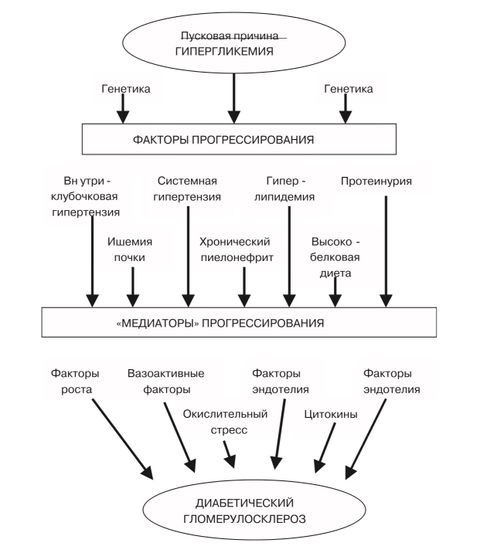
-
@Верхом-на-заезде
Бенфотиамин жирорастворимый ,снижает Глики́рованный гемоглобин А1с , Гликированные соединения ,
600 мг в сутки рекомендованная порция ,американской ассоциацией здравоохранения -
Скрининг
Фруктозамин ,гликированный альбумин
Позволяет отследить уровень сахара за три недели , наиболее выгодные для отслеживания пред диабета
Чем скрининг Hba1c Гликированный гемоглобин за три месяца -
@Верхом-на-заезде , ты сам с собой разговариваешь или ты просто записную книжку свою здесь сохраняешь, как в облако?
-
Сердечно–сосудистые осложнения – инфаркт, инсульт развиваются в 2–4 раза чаще, артериальная гипертония осложняется инсультом в 2 раза чаще у лиц, страдающих СД, чем без него.
• Слепота развивается в 25 раз чаще у лиц с диабетом; при длительности диабета 15 лет у 10% больных развиваются серьезные нарушения зрения.
• Диабет – лидирующая причина почечной недостаточности в развитых странах мира; причина 35–40% новых случаев конечной стадии ХПН ежегодно.
• Нейропатия поражает прежде всего нижние конечности и приводит к хроническим язвам и ампутациям; ампутация ног при диабете в 25 раз более вероятна [2].
Лечение осложнений СД является основной затратной частью прямых расходов здравоохранения и причиной госпитализации, инвалидности и снижения качества жизни людей во всех странах.
Основной причиной микро– и макрососудистых осложнений СД является хроническая гипергликемия, которую сложно устранить путем модификации стиля жизни и назначением сахароснижающих препаратов. Практически целевые критерии компенсации СД для предотвращения сосудистых повреждений подразумевают достижение даже не около нормальных, но практически нормальных показателей гликемического контроля пожизненно для этой цели. Так, последним Всемирным руководством для ведения таких больных c целью профилактики осложнений рекомендовано достигать уровня гликемии плазмы крови ниже 6,0 ммоль/л натощак и 8,0 ммол/л после еды, а гликированного гемоглобина HbA1c<6,5% [3].
В 2001 году американским ученым Браунли (Brownlee) выдвинута гипотеза о механизме, объединяющем все возможные пути сосудистого повреждения вследствие гипергликемии [4]. Этим связующим звеном индукции окислительных и воспалительных изменений в клетках, по предположению Браунли, явилось избыточное выделение супероксидных радикалов (СО) в митохондриальной электронно–транспортной системе. В норме супероксидные радикалы генерируются в незначительных количествах и обладают защитным действием, но в условиях хронической гипергликемии их образование приобретает чрезмерный характер. Поток СО радикалов приводит к окислительной активации поли (аденозинфосфат–рибозы)полимеразы (PARP), которая ингибирует гликолитический фермент глицеральдегид–3–фосфатдегидрогеназу (GAPDG) (рис. 1).
Глицеральдегид–3–фосфат/дегидрогеназа – ключевой фермент, участвующий в регуляции активности всех промежуточных вышележащих метаболитов глюкозы. Снижение активности этого фермента вызывает восходящее нарушение регуляции метаболизма глюкозы с активизацией всех 4 основных боковых путей ее превращения:
• альдозоредуктазного пути с накоплением сорбитола в клетках;
• гексозаминового пути, который приводит к истощению запасов клеточного глютатиона;
• активацию протеинкиназы С и активацию редокс–сенситивного транскрипционного фактора NfkB, который стимулирует транскрипцию и экспрессию провоспалительных цитокинов, таких как TNFa;
• Глицеральдегид–3–фосфата в трифосфатоксоальдегид и далее в конечные продукты гликирования (КПГ), вызывающие поражения сосудистой стенки генерализованного характера.
Наиболее изученным препаратом, блокирующим образование КПГ, является аминогуанидин. Аминогуанидин предотвращает образование КПГ путем нейтрализации оксоальдегидов, которые образуются либо путем распада продукта Амадори, либо путем перегрузки клеток метаболитами глюкозы. Проводимые в течение двух десятилетий исследования на животных показали, что аминогуанидин значительно снижает продукцию КПГ и предотвращает потерю почечной функции, жесткость артерий, сердечную гипертрофию, потерю функции нервов и сетчатки при предварительных исследованиях лекарства у лиц с СД.
К сожалению, в нескольких исследованиях с аминогуанидином оказалось, что он способен вызывать индуцированные аутоиммунные состояния, в связи с чем клинические испытания препарата в Европе были прекращены [5,6].
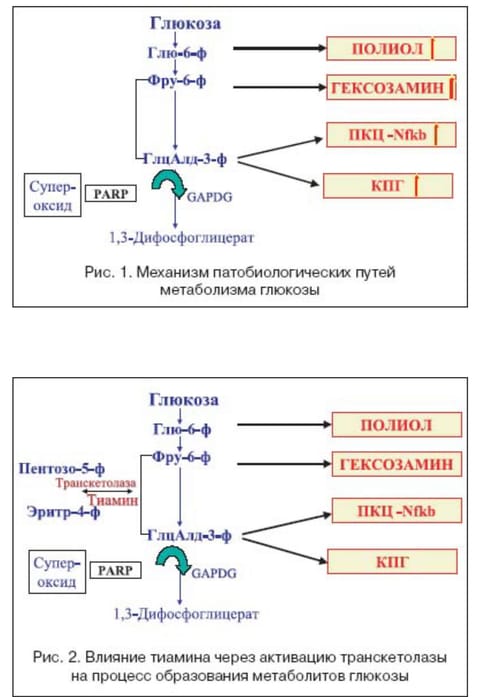
В 1996 году исследователи обнаружили, что потенциальными свойствами предотвращать образование КПГ обладает тиаминпирофосфат – активная форма коэнзима витаминного комплекса В – тиамина. Тиаминпирофосфат оказался способным останавливать образование превращение продукта Амадори в КПГ. Кроме того, было обнаружено, что тиаминпирофосфат способен в условиях гипергликемического стресса открывать «сброс» избытка метаболитов глюкозы путем активации энзима транскетолазы [7]. Активация этого энзима способствует как бы шунтирующему эффекту – удалению избытка промежуточных продуктов глюкозы, предотвращающих перегрузку ее метаболитами (рис. 2).
Фармакокинетика тиамина
и бенфотиамина
К сожалению, возможности человеческого организма абсорбировать и метаболизировть достаточное для предотвращения избыточного гликирования белка количество тиамина из пищи весьма ограничены. Обычная водорастворимая форма тиамина не проходит беспрепятственно через клеточную мембрану. Для ее прохождения требуется специальная транспортная насосная система. Проблема заключается не только в невысокой кишечной абсорбции, но и в низкой биодоступности. При парентеральном введении тиамина в дозе 5 мг почки выводят 25% вводимой дозы витамина. При дальнейшем увеличении количества вводимого тиамина клеточная абсорбция не возрастает. При введении, например, 100 мг тиамина – 100% дополнительного количества, превышающего 5 мг, выводится с мочой [8].
Японскими исследователями 50 лет назад обнаружен путь, позволяющий значительно увеличивать количество тиаминпирофосфата [9]. Ученые обнаружили следовые компоненты производных тиамина в подвергнутом кулинарной обработке чесноке, а далее и в других луковичных овощах семейства allium (репчатый лук, лук–шалот, лук–порей) и назвали эти вещества аллитиаминами. Изменение структуры тиазольного кольца в аллитиаминах позволяет им проникать непосредственно через клеточную мембрану как в стенке кишечника, так и в других тканях. Как только аллитиамины попадают внутрь клетки, их структура видоизменяется и они способны превращаться в тиаминпирофосфат и далее активировать транскетолазный шунт. В результате абсорбция аллитиаминов происходит лучше, а уровень транскетолазы остается высоким в течение длительного времени [8,10,11].
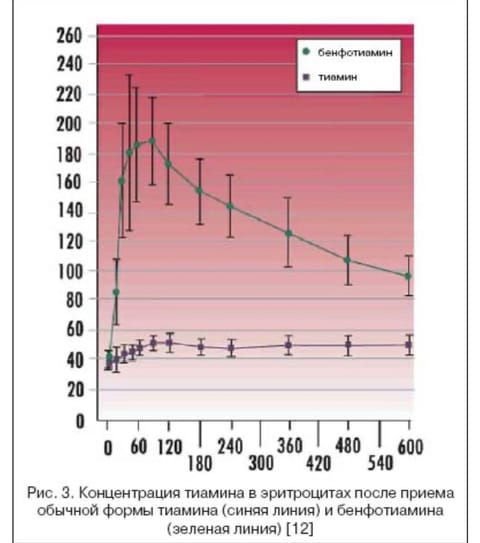
Наиболее эффективным аллитиамином и единственным с доказанной способностью снижать уровень КПГ является бенфотиамин. Абсорбция тиамина из бенфотиамина происходит в 5 раз быстрее (рис. 3), чем из обычного витаминного комплекса [12]. На клеточном уровне эффект бенфотиамина превышает в 5–25 раз действие обычного тиамина. Кроме того, токсичность бенфотиамина меньше, чем тиамина [13,14].
В исследованиях показано, что бенфотиамин значительно увеличивает содержание тиаминпирофосфата, который снижает уровень КПГ. В одном исследовании [15] демонстрируется возрастание тиаминпирофосфата в 120 раз, в другом, проведенном у гемодиализных больных, показано достижение 430% концентрации тиаминпирофосфата по сравнению с традиционным тиамином [16]. Кроме того, наиболее важным результатом воздействия бенфотиамина является значительное увеличение активности транскетолазы [8,13]. Если водорастворимая форма тиамина повышает ее активность на 20%, то жирорастворимая форма – бенфотиамин повышает активность транскетолазы на 400%. Таким образом, он подавляет все 4 патобиохимические пути превращения глюкозы, которые ответственны за сосудистые повреждения при сахарном диабете (рис. 2).
Исследования, проведенные на животных, подтвердили способность бенфотиамина, эффективно препятствовать развитию диабетической ретинопатии у крыс, у которых при помощи стрептозотоцина был индуцирован СД. Под воздействием бенфотиамина показатель нарушений эндотелия, вызванных гипергликемией – количество бесклеточных капилляров глаза через 36 недель находился на уровне здоровых животных. При обычном развитии болезни большинство перицитов было разрушено и была индуцирована ретинопатия. Обнадеживающими являются экспериментальные исследования, проведенные на животных по диабетической нефропатии [16,17].
Если экстраполировать дозы, вводимые экспериментально животным на человека, то получится, что суточная доза бенфотиамина составит от 400 до 600 мг (4–6 драже Мильгаммы).
Токсичность
и переносимость бенфотиамина
Бенфотиамин обладает чрезвычайно низкой токсичностью. В исследованиях хронической токсичности крысам линии Вистар назначались ежедневно по 100 мг/кг бенфотиамина, при этом через 3 и 12 месяцев не было обнаружено задержки развития или тератогенного эффекта. Бенфотиамин характеризуется очень хорошей переносимостью. При длительном приеме препарата Мильгамма очень редко встречаются головные боли и аллергические реакции.
Пиридоксин, или витамин В6, содержится в 1 драже Мильгаммы в количестве 100 мг, то есть суточная доза пиридоксина при длительном приеме будет составлять 300–600 мг. Физиологическое значение пиридоксина – участие в обмене аминокислот. При использовании мега–доз пиридоксина более 2000 мг в сутки в течение периода более 2 месяцев может развиться токсическая сенсорная нейропатия. Опубликованы единичные случаи развития токсической нейропатии при приеме 300 мг пиридоксина в течение 6 месяцев [18].
Конечные продукты гликирования
и их роль в организме
Конечные продукты гликирования (КПГ), или Advanced Glycation Endproducts (AGEs), являются конечным результатом комплекса биохимических процессов, когда структура белковых субстанций нарушается при взаимодействии с глюкозой или более реактивными молекулами в организме. Этот процесс образования КПГ происходит в организме человека и животных постоянно и повсеместно: в артериях, почках, сердце, коже, нервах.
Данный процесс реакций, особенно вышедший из под контроля, как например, при СД, способствует не только нарушению структуры протеинов, но и снижению функции энзимов, запуску нездоровых биохимических сигналов в клетках, повреждению молекул ДНК и ускорению процесса старения.
Чем выше уровень глюкозы в организме, тем выше и количество КПГ и гликированных белков. В результате люди, страдающие СД, имеют значительно более высокие показатели значений КПГ и процесс «старения» у них происходит быстрее и раньше.
Источниками КПГ также могут служить экзогенные факторы, а именно курение и пища. Установлено, что в зависимости от времени, температурного режима и вида кулинарной обработки зависит и количество поступающих в организм КПГ. Так, при приготовлении пищи на открытом огне, например, обжаривании на сковородке грудок цыпленка в течение 15 минут на 1 г продукта образуется 61 единица КПГ, а при отваривании в течение 10 минут – только 12 единиц. Свежие фрукты и овощи содержат небольшое количество КПГ.
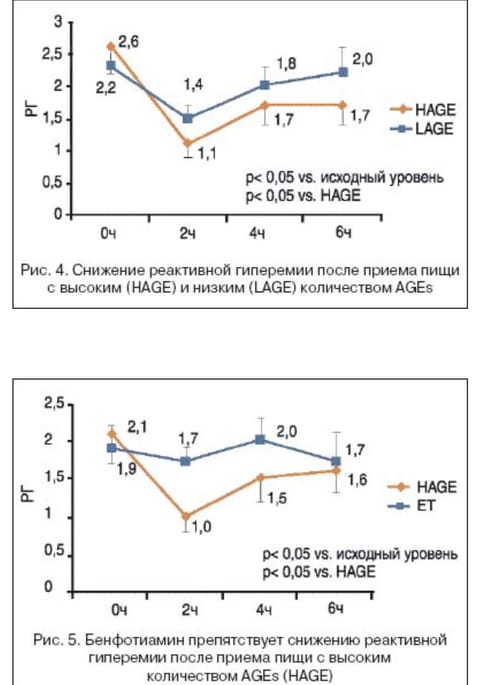
Установлено, что поступление пищи вызывает острое преходящее нарушение микрососудистой дисфункции, что подтверждено методом измерения реактивной гиперемии при лазерной допплеровской флоуметрии. Недавно было показано, что при при СД 2 типа прием пищи, богатой КПГ, вызывает более значительное нарушение микрососудистой функции (снижение ответа на реактивную гиперемию, рис. 4), чем пища с низким содержанием КПГ [25]. Предварительный прием бенфотиамина (Мильгаммы драже) предотвращал острую постпрандиальную микрососудистую дисфункцию у больных СД 2 типа (рис. 5). Исследования в этой области продолжаются.
Клинические доказательства
эффективности бенфотиамина
при диабетической нейропатии
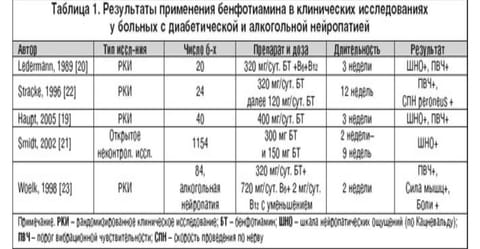
Если перспективы применения бенфотиамина при нефропатии и ретинопатии требуют проведения длительных доказательных исследований на человеке, то его нейропротекторное действие показано в 4 слепых рандомизированных исследованиях (табл. 1).
Результаты проведенных исследований показывают эффективность обезболивающего действия бенфотиамина при симптомной диабетической и алкогольной нейропатии в результате применения препарата в дозе 320 мг перорально в сутки или в комбинации с другими нейротропными препаратами в краткосрочных исследованиях длительностью от 2 до 12 недель. Происходит некоторое улучшение объективных критериев состояния периферического нерва: улучшение порога вибрационного чувства, скорости проведения по нерву независимо от метаболического контроля. При проведении исследований отмечена благоприятная переносимость бенфотиамина (Мильгаммы) без каких–либо серьезных побочных эффектов.
В последнем рандомизированном плацебо–контролируемом исследовании BEDIP [19] пероральный прием бенфотиамина в дозе 400 мг в сутки у больных СД 1 и 2 типа с признаками периферической симптомной нейропатии в течение 3 недель привел к статистически значимой положительной динамике шкалы нейропатических ощущений, особенно болевой составляющей («стреляющих» болей, жжения в стопаx) по сравнению с плацебо. Отмечена более высокая рейтинговая оценка, данная врачами и пациентами, в сравнении между группами. Не наблюдалось статистически значимых улучшений порога вибрации, что, вероятно, объясняется временными параметрами исследования. Однако клиническое улучшение, возможно, является наиболее важным результатом исследования и ранее показано, например, при проведении многоцентрового исследования с a–липоевой (тиоктовой) кислотой – ALADIN [24].
В процессе плацебо–контролируемого двойного слепого исследования бенфотиамин в комбинации с витаминами В6 и В12 значительно уменьшил боль и улучшил сенсорную функцию [Ledermann and Widney, 1989]. Stracke et al. (1996) выявили 30%–е снижение сенсорного порога вибрации на второй пястной и плюсневой костях в противоположность незначительному повышению в группе плацебо. Воздействие терапии на скорость проведения по нерву в этом исследовании было еще более выраженным, демонстрируя повышение скорости проведения в малоберцовом нерве и ее понижение при использовании плацебо. Статистически значимое улучшение сенсорной функции нервных окончаний при использовании бенфотиамина было явлено у бессимптомных больных СД молодого возраста [Barkai et al., 1998], улучшение функции автономной нервной системы после терапии бенфотиамином было показано в экспериментальном исследовании [27].
Таким образом, терапевтическая эффективность бенфотиамина при диабетической нейропатии может иметь патогенетическое обоснование, учитывая возможность его влияния на транскетолазу, тем самым на пентозо–фосфатный путь обмена глюкозы. Терапевтические перспективы бенфотиамина открывают новые возможности использования Мильгаммы в патогенетическом лечении сосудистых осложнений сахарного диабета. -
-
Интересно, хоть один человек прочтет эти вырезки из Википедии полностью? Которые непонятно зачем этот безумный ксерокс дублирует сюда.
-
Пользователь @Васьвась написал в ВИЧ и диабет:
Интересно, хоть один человек прочтет эти вырезки из Википедии полностью? Которые непонятно зачем этот безумный ксерокс дублирует сюда.
А мне интересно когда он свалит отсюда вслед за Марічкой?
